
▲셀트리온 인천 송도 공장. 사진=셀트리온
셀트리온이 올해 들어서만 4종의 바이오시밀러 제품에 대해 미국 식품의약국(FDA) 품목허가를 획득하는 기염을 토했다.
이들 4개 오리지널 의약품의 매출규모만 총 20조원에 육박해 셀트리온의 올해 매출 5조원 목표에도 탄력이 붙을 전망이다.
셀트리온은 천식·만성 특발성 두드러기 치료제 졸레어 바이오시밀러 '옴리클로'(성분명 오말리주맙)가 미국 식품의약국(FDA)으로부터 품목허가를 획득했다고 10일 밝혔다.
오리지널 의약품이 보유한 전체 적응증에 대해 허가를 획득한 옴리클로는 미국에서 처음 허가를 받은 졸레어 바이오시밀러일 뿐만 아니라 오리지널과 교차 처방이 가능한 '상호교환성(인터체인저블) 바이오시밀러'라는 점에서 향후 빠른 시장안착 및 오리지널 시장점유율 잠식이 기대된다.
노바티스가 개발한 졸레어는 지난해 글로벌 매출 약 6조원을 올린 블록버스터 의약품이다. 이 중 미국 시장규모만 3조7000억원에 이른다.
앞서 셀트리온은 지난 1월 로슈가 개발한 류마티스관절염 등 자가면역질환 치료제 악템라 바이오시밀러 '앱토즈마'(성분명 토실리주맙)에 대해 FDA 허가를 획득했다. 악템라 역시 글로벌 매출 4조원의 블록버스터 의약품이다.
이어서 이달 초에는 암젠이 개발한 골다공증 치료제 프롤리아 바이오시밀러 '스토보클로'(성분명 데노수맙)와 역시 암젠의 골거대세포종 치료제 엑스지바의 바이오시밀러 '오센벨트'(성분명 데노수맙)에 대해 각각 FDA 허가를 획득했다.
프롤리아와 엑스지바는 성분은 같지만 적응증이 다른 별개의 의약품으로, 두 제품의 합산 매출은 약 9조2000억원에 이른다.
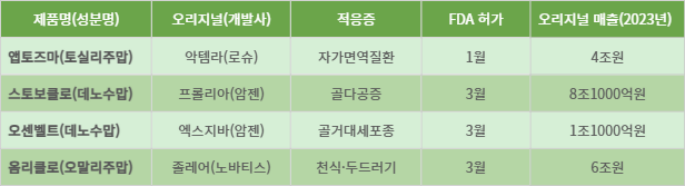
셀트리온의 올해 美 FDA 승인 획득 블록버스터급 바이오시밀러 제품군
▲자료=셀트리온
이로써 셀트리온은 지난 2016년 자가면역질환 바이오시밀러 '램시마'(오리지널 의약품 레미케이드)에 대해 처음 미국 FDA 허가를 획득한 이후 지금까지 총 11개의 FDA 허가 품목을 보유하게 됐다.
그 중 올해 들어서만 4개 품목을 허가받았으며 이들 4개 품목 모두 오리지널 의약품이 연매출 1조원 이상의 블록버스터라는 점에서 올해 셀트리온의 매출 성장세가 주목된다.
셀트리온에 따르면, 미국에서 허가받은 바이오시밀러 제품인 △램시마 △짐펜트라 △유플라이마 △스테키마 △허쥬마 △트룩시마 △베그젤마 △앱토즈마 △스토보클로 △오센벨트 △옴리클로 등 제품 11종의 오리지널 의약품 글로벌 시장규모만 약 123조원에 이른다.
셀트리온은 올해 미국, 유럽 등에서 각각 11종 이상의 제품을 확보해 연매출 5조원을 달성하고, 오는 2030년까지 총 22개 제품을 확보해 연매출 12조원을 달성한다는 목표를 세워두고 있다.
업계는 미국 바이든 정부에 이어 트럼프 정부도 자국민 약가부담 경감을 위해 바이오시밀러 시장 확대에 적극적인 만큼 미국 바이오시밀러 시장이 빠르게 성장할 것으로 전망하고 있다.
셀트리온 관계자는 “최근 글로벌 주요국에서 바이오시밀러의 품목허가 승인을 잇따라 획득하며 자체 제품 개발역량을 재입증하고 있다"며 “남은 후속 파이프라인의 허가 절차를 차질 없이 마무리하는 한편 허가 받은 제품이 시장에 조속히 정착해 매출 확대로 이어지도록 전력을 다할 예정"이라고 밝혔다.


![[카드사 풍향계] 삼성카드, ‘토스 삼성카드’ 출시…토스페이 결제 15% 할인 外](http://www.ekn.kr/mnt/thum/202508/news-p.v1.20250818.91caf6c9b61a4fd29665cf132654ae64_T1.jpg)






![[보험사 풍향계] 교보생명 사내벤처 4기 출범…“AI로 보험 혁신” 外](http://www.ekn.kr/mnt/thum/202508/news-p.v1.20250818.f5ca65c708144b3a986e7174c4284f66_T1.jpg)

![[EE칼럼] 재생에너지의 역설, 좌초자산의 덫에 빠지다](http://www.ekn.kr/mnt/thum/202508/news-p.v1.20250702.05b45b3b37754bef91670415ae38a4b8_T1.jpg)

![[이슈&인사이트] 아시아나 과징금 사태, 공정 경쟁의 새 출발점 돼야](http://www.ekn.kr/mnt/thum/202508/news-p.v1.20240405.216378e10c3244be92f112ed66527692_T1.jpg)
![[데스크 칼럼] 성장이라는 마라톤, 발목에 모래주머니](http://www.ekn.kr/mnt/thum/202508/news-p.v1.20250817.db44a2e96f864207831ca7964cba1783_T1.jpeg)
![[기자의 눈] 1020세대 사로잡은 갤럭시폰의 ‘아재폰’ 꼬리표 떼기](http://www.ekn.kr/mnt/thum/202508/news-p.v1.20250818.f91fe45c460c439c88837ba5a734326b_T1.jpg)










